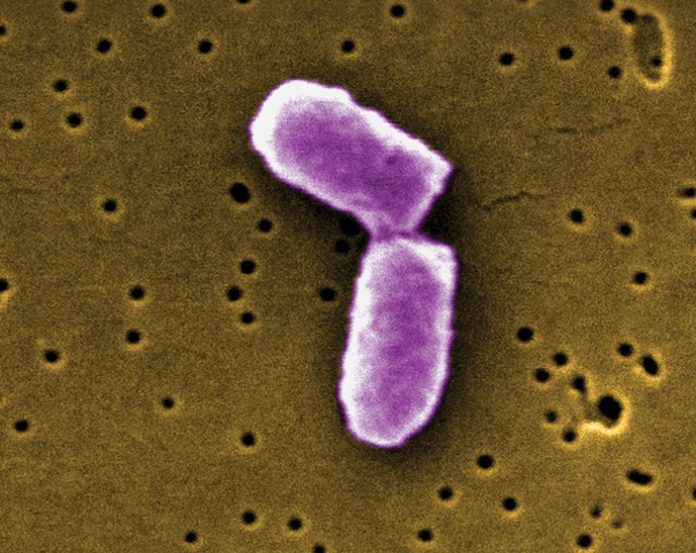
Рис. 1. Кишечная палочка (Escherichia coli) под конец деления. Изображение, полученное при помощи сканирующего электронного микроскопа, с сайта britannica.com
Одноклеточные организмы редко обсуждаются в дискуссиях о природе старения, поскольку все еще непонятно, как у них измерять само старение. Тем не менее, именно они несут в себе ключ к разгадке вечного вопроса: универсально ли старение для всех живых существ или это вторично приобретенный признак. Французский исследователь Эрик Баптест с коллегами построил модель старения одноклеточных, согласно которой каждое их деление асимметрично — даже если внешне обе клетки-потомка выглядят равноценными. Из этой модели следует, среди прочего, что механизмы омоложения есть у любого организма, а бактерия, с точки зрения геронтологии, — многоклеточное существо.
Современная наука о старении вынуждена существовать в условиях, когда на самые базовые ее вопросы до сих пор нет однозначных ответов. Мы не только не знаем, как точно определить старение, почему живые организмы стареют и одинаковы ли причины этого процесса у разных видов, но даже не можем с уверенностью сказать, всех ли он затрагивает. Чтобы продвинуться в этом споре, необходимо либо обнаружить какой-то признак старения, который заведомо объединяет все живое на Земле, либо найти пример организма, у которого никаких признаков старения не наблюдается. В качестве таких примеров иногда приводят гидру (Hydra vulgaris, см. D. E. Martinez, 1998. Mortality Patterns Suggest Lack of Senescence in Hydra). Впрочем, не все геронтологи согласны включить ее даже в список пренебрежимо стареющих (то есть таких, у которых незаметны признаки старения) животных, не говоря уж о бессмертных. Для этого пока недостаточно данных. Другим распространенным примером часто служит голый землекоп, но ему повезло еще меньше: то и дело у него подмечают то снижение плодовитости, то опухоли, то возрастные болезни, что уж совсем нехорошо для потенциально нестареющего вида (см. C. E. Finch, 2009. Update on slow aging and negligible senescence — a mini-review, а также новость Геном голого землекопа — ключ к секрету долголетия?, «Элементы», 11.11.2011).
Так или иначе, большинство этих споров разворачивается в пространстве царства Животных, все члены которого многоклеточные. А вопросы о старении одноклеточных — как прокариот, так и эукариот — как правило, обходят стороной. И это неспроста: дело в том, что по поводу одноклеточных нет согласия не только в том, стареют ли они в принципе, но и в том, как это старение измерять.
Старение в капле воды
Строго говоря, измерить старение у животных тоже непросто. Способов известно множество, и каждый выбирает свой. Кто-то меряет по плодовитости и жизнеспособности потомства в зависимости от возраста родителей, кто-то — по количеству возрастных болезней, кто-то — по накоплению разного рода поломок (белковых агрегатов, мутаций в ДНК и так далее). Чаще всего, пожалуй, измеряют смертность: подсчитывают какое количество особей-сверстников остается в популяции в каждый момент времени. Эта методика апеллирует к закону Гомперца: у стареющего организма с возрастом растет риск умереть от естественных причин. Из этого принципа уже нашлось немало исключений (см. Детская смертность от унаследованных мутаций маскирует раннее начало старения, «Элементы», 29.01.2020), но, за неимением лучшего, многие исследователи продолжают им пользоваться.
С одноклеточными дело обстоит еще сложнее. Допустим, мы, следуя методике для животных, соберем группу одноклеточных одного возраста и решим измерять их смертность, то есть моменты, когда клетки прекращают свое существование. Это может случиться по разным причинам: внешним (клетку могут раздавить или лишить еды), внутренним (клетка может накопить мутации, несовместимые с жизнью) или в результате размножения. Разделившись на две дочерние клетки, материнская, очевидно, перестает существовать. Значит ли это, что, чем быстрее популяция размножается, тем быстрее она стареет? А если, наоборот, считать, что жизнь материнской клетки продолжается в дочерних, то становится непонятно, как учитывать смертность. Поэтому, когда речь заходит о старении одноклеточных, каждому исследователю приходится выбирать, с какой стороны смотреть на этот процесс (см. M. Florea, 2017. Aging and immortality in unicellular species).
Один вариант — изучать репликативное старение, то есть потерю одноклеточными способности размножаться. Измерить его несложно: достаточно посадить одну клетку в среду с постоянным избытком ресурсов (например, пространства и пищи) и подсчитывать количество ее потомков в культуре. И действительно, есть работы — например, на кишечной палочке Escherichia coli и некоторых видах дрожжей — которые показывают, что даже в таких условиях клетка не способна размножаться вечно.
Это тот же феномен, который давно известен и для животных клеток, — какую клетку человека ни возьми, рано или поздно она делиться перестанет. Долгое время так даже измеряли «возраст» отдельно взятых клеток — давали возможность размножаться и считали, сколько «раундов» они продержатся и сколько потомков образуют. Чем плодовитее — тем моложе. Считается, что у нас за репликативное старение ответственны теломеры — «набойки» на концах хромосом, которые с каждым делением укорачиваются, пока не достигают критической длины, за которой деление невозможно (см. Нобелевская премия по физиологии и медицине — 2009, «Элементы», 10.10.2009). У дрожжей теломеры тоже есть, а вот у прокариот хромосомы кольцевые, следовательно, должны существовать и другие механизмы, ответственные за репликативное старение. Это может быть, например, накопление мутаций — то самое, которое, как гласит мутационная теория Медавара (см. Mutation accumulation theory), вносит свой вклад и в изнашивание многоклеточных организмов.
Второй способ рассматривать старение одноклеточных — изучать старение в условиях ограничений (conditional senescence). Для этого культуру одноклеточных нужно поместить в какие-то условия, которые препятствуют их размножению: это может быть ограниченное пространство, дефицит еды или действие какого-нибудь стрессового фактора, например, антибиотика. Со временем количество клеток в культуре будет уменьшаться (чем-то напоминая закон Гомперца, см. Y. Yang et al., 2019. Temporal scaling of aging as an adaptive strategy of Escherichia coli) — то есть они будут терять не столько способность размножаться, сколько способность продолжать жизнедеятельность, поэтому мы можем для простоты этот вид старения назвать физиологическим. Причин здесь тоже может быть несколько: в стрессовых условиях одноклеточные существа накапливают активные формы кислорода, поврежденные белки и прочий «молекулярный мусор» — и этим, кстати, тоже напоминают клетки животных, которые внутри организма то и дело подвергаются каким-нибудь стрессам (то голоданию, то воспалению, то перегреву, то охлаждению и так далее без конца).
Рис. 2. Кривая Гомперца (зависимость риска умереть от возраста) для человека (слева) и для кишечной палочки (справа). Рисунки с сайта en.wikipedia.org и из статьи Y. Yang et al., 2019. Temporal scaling of aging as an adaptive strategy of Escherichia coli
Впрочем, не стоит думать, что репликативное старение и старение физиологическое — две взаимоисключающие теории. Скорее всего, оба этих процесса имеют место, но на разных стадиях жизненного цикла одноклеточного организма. Представим себе, что клетка попала в новую среду — скажем, незаселенную ее родственниками каплю воды. Тогда поначалу она будет активно размножаться и стареть репликативно. Затем ее потомки заполнят всю каплю, ресурсы начнут иссякать, и репликативное старение уступит место физиологическому. Часть клеток ослабнет, погибнет, освободится пространство, и цикл замкнется. Понятно, что переход от репликативного старения к физиологическому и обратно едва ли будет резким, и на каком-то этапе цикла два этих процесса будут действовать на жителей капли одновременно. Кроме того, нельзя исключать и того, что эти процессы как-то взаимосвязаны — например, генетический мутационный «мусор» наверняка влияет на скорость накопления мусора белкового, и наоборот. Однако эти связи пока не особенно изучены.
Двуглавая палочка
Однако сочетание двух форм старения одноклеточных рисует мрачную картину: колония микробов сначала теряет способность размножаться, потом жизнеспособность, потом снова способность размножаться… Если бы так продолжалось без конца, то виды одноклеточных вымирали бы один за другим. Следовательно, у них должны существовать еще и какие-то механизмы омоложения, для каждого конкретного организма или для популяции в целом.
Чтобы разрешить это противоречие у многоклеточных животных, Томас Кирквуд выдвинул теорию «одноразовой сомы» (см. T. Kirkwood, R. Holliday, 1979. The evolution of ageing and longevity). Она предполагает, что в многоклеточном теле есть нестареющая часть — половые клетки (germ cells, germ line), а есть все остальное — сома. Преемственность жизни осуществляется только на уровне половых клеток, которые участвуют в оплодотворении, затем делятся и образуют новые половые клетки. А сома — лишь надстройка, необходимая для обеспечения жизни половых клеток, которая и принимает на себя удар разных форм старения — как репликативного, так и физиологического. Иными словами, клетки половой линии находятся в покоящемся состоянии, у них невысокая интенсивность обмена веществ, зато много ресурсов уходит на постоянный саморемонт. Клетки сомы же тратят энергию на рост, деление, синтез макромолекул — и в меньшей степени на ремонт, потому и изнашиваются со временем.
У теории «одноразовой сомы», конечно, есть свои ограничения. Известно, что половые клетки не «безгрешны» и годы тоже накладывают на них свой отпечаток — например, в пожилых яйцеклетках чаще возникают хромосомные аномалии после мейоза, чем в молодых. То есть непонятно, на самом деле, в какой степени половые клетки защищены от старения. Кроме того, одной такой защиты едва ли будет достаточно: можно представить себе, что за время, которое проходит между оплодотворением и образованием половых желез у зародыша, клетки успевают накопить какие-то поломки. А значит, необходимы дополнительные механизмы омоложения, чтобы новое поколение не оказывалось каждый раз слабее старого.
Тем не менее, факт остается фактом: признаков старения у половых клеток гораздо меньше, чем у клеток сомы, да и процессов омоложения у последних не заметно. Поэтому теория сомы продолжает неплохо объяснять то, что происходит в многоклеточном организме. Но возможно ли ее применить к одноклеточным? А если да, то на каком уровне у них могут существовать сома и половая линия, если клетка у каждого организма всего одна?
В мире микробов есть хорошие примеры того, как идея «одноразовой сомы» может работать в масштабах одной клетки. Это виды, которые практикуют асимметричное деление — например, пекарские дрожжи (Saccharomyces cerevisiae) или пресноводная бактерия Caulobacter crescentus. В случае почкующихся дрожжей старение изрядно напоминает человеческое (см. R. S. Petralia et al., 2014. Aging and longevity in the simplest animals and the quest for immortality): клетка сморщивается, накапливает шрамы от предыдущих почек, уровень синтеза белка падает, цитоплазма закисляется. Как только эта клетка становится материнской, то есть начинает отращивать новую почку, она автоматически превращается в сому. Дочерняя же клетка не наследует ни изношенной мембраны, ни других повреждений и принимает на себя роль половой линии, рождаясь с молекулярной точки зрения более молодой, чем ее мать.
Впрочем, далеко не у всех одноклеточных описано асимметричное деление. Родственники пекарских дрожжей Schizosaccharomyces pombe и кишечная палочка Escherichia coli, как правило, делятся симметрично (рис. 3): глядя в микроскоп, мы не видим никаких различий между двумя дочерними клетками. Значит ли это, что у них нет механизмов омоложения, а вместе с тем — и механизмов старения?
Рис. 3. Симметричное и асимметричное деление встречаются как у прокариот, так и у эукариот. Изображение из статьи M. Florea, 2017. Aging and immortality in unicellular species
Этим вопросом задался французский биолог Эрик Баптест (Eric Bapteste) со своими коллегами. Поскольку нет причин думать, что существуют виды, которые не накапливают мутации или молекулярный мусор с течением времени, то есть не стареют, исследователи предположили, что даже у симметрично делящихся одноклеточных должны быть какие-то механизмы омоложения. Но где его искать, в какой фазе жизненного цикла? Баптест и коллеги предложили четыре варианта ответа на этот вопрос (первые три из которых они сами же и опровергли):
1. Омоложение происходит в случайное время. Этот вариант кажется довольно невыгодным, поскольку чем дольше особь живет, тем сложнее ее вернуть к исходному состоянию. Следовательно, с течением времени омоложение должно постепенно сдвигаться к «началу жизни» одноклеточного — какой бы момент мы ни договорились считать этим началом.
2. Омоложение происходит постоянно. Это тоже не самый экономный вариант. К тому же омоложение приносит наибольший выигрыш только тем, кто близок к «порогу» репродуктивного старения и готов остановить свое размножение. Значит, в таком случае для молодых особей оно выгодным не будет.
3. Омоложение совершается в критические моменты, как ответ на внешний «сигнал тревоги» — например, когда популяция достигает пороговой численности. Такое действительно встречается даже у симметрично делящихся видов: тех же S. pombe, которые в трудную минуту переходят к асимметричному делению (M. Coelho et al., 2013. Fission Yeast Does Not Age under Favorable Conditions, but Does So after Stress), или у E. coli, которая изредка способна отпочковывать от себя миниклетки, набитые «мусором» (C. U. Rang et al., 2018. Minicells as a Damage Disposal Mechanism in Escherichia coli). Но этот механизм перехода к асимметрии не может быть единственным средством омоложения, ведь в некритической ситуации дрожжи тоже не должны стареть.
4. Омоложение происходит регулярно, причем в такой момент, который есть в жизненном цикле любого существа, будь оно одно- или многоклеточным. Таким моментом Баптест и коллеги сочли митоз.
Нечестное деление
Сама по себе идея о том, что во внешне равном делении скрыта тайная асимметрия, не нова. Некоторые исследовательские группы давно уже заняты поисками различий между одинаковыми на первый взгляд дочерними клетками (E. J. Stewart et al., 2005. Aging and Death in an Organism That Reproduces by Morphologically Symmetric Division), и успели кое-что обнаружить. Так, группа Лина Чао (Lin Chao) из Калифорнийского университета в Сан-Диего разработала модель асимметричного деления кишечной палочки (L. Chao et al., 2016. Asymmetrical damage partitioning in bacteria: a model for the evolution of stochasticity, determinism, and genetic assimilation). Чао и его коллеги подметили, что, даже если деление E. coli на две части симметрично, то каждая дочерняя клетка сама по себе симметрией не обладает. Более того, поскольку эта бактерия имеет форму палочки, дочерним клеткам присуща выраженная асимметрия полюсов: один они наследуют от материнской клетки (старый полюс), а другой строится в процессе деления (новый, молодой полюс) (рис. 4).
Рис. 4. Концепция старых и молодых полюсов. Цифры обозначают относительный возраст отдельных полюсов и клетки в целом. Изображение из статьи M. Florea, 2017. Aging and immortality in unicellular species
Чтобы заметить признаки истинной асимметрии, стоит смотреть не на первое поколение, а на второе. После первого деления каждая из клеток унаследовала по одному старому полюсу, и в этом смысле они равны. А вот после второго деления возникает несправедливость: половина клеток наследует «дважды» старый полюс, что может всерьез повлиять на их состояние. И действительно, «старые» клетки кишечной палочки (со старыми полюсами), по данным группы Чао, размножаются медленнее и хуже, чем молодые.
Тем не менее, заметные различия между старыми и молодыми бактериями появляются не во всех экспериментах, и, как правило, под действием сильного стрессового фактора, вроде высоких концентрации антибиотиков. Это можно объяснить следующим образом (S. Vedel et al., 2016. Asymmetric Damage Segregation Constitutes an Emergent Population-Level Stress Response). Молодые клетки делятся быстро и достигают некоторой пороговой скорости деления — она ограничена размером клеток (поскольку делиться без остановки невозможно, нужно успевать дорастать до нужных пропорций) и доступным пространством. Старые клетки делятся медленнее, но каждое деление позволяет им разбавить количество «старых» молекул и повреждений, поэтому для них деление тоже выгодно. И со временем они тоже достигают равновесной скорости — настолько высокой, насколько позволяет их возраст. Но чем сильнее стресс, тем больше клетки накапливают повреждений, и тем ниже скорость деления, которую они могут себе позволить. Поэтому при сильном стрессе разница между молодыми и старыми становится заметна гораздо лучше (рис. 5). В этом смысле одноклеточные ничем не отличаются от людей.
Рис. 5. Сильный стресс увеличивает разрыв в скорости размножения между молодыми и старыми клетками кишечных палочек. Изображение из статьи M. Florea, 2017. Aging and immortality in unicellular species
В недавней работе группа Чао привела еще одно доказательство асимметрии в клетках E. coli. Исследователи заставили кишечную палочку производить зеленый флуоресцентный белок и измеряли интенсивность свечения в разных участках материнских клеток и их потомков. Как и следовало ожидать, они заметили, что старые полюса светятся слабее, чем новые (рис. 6). Иными словами, асимметрия между внучками исходной клетки выражается не только в абсолютном возрасте областей клетки, но и в конкретных физиологических процессах: старые полюса производят меньше белка, чем остальные. Исследователи полагают, что синтезу белка, как и другим жизненным процессам, мешает молекулярный «мусор» (в данном случае — агрегаты сломанных белков), причем мешает сугубо механически: не оставляет места для необходимого количества рибосом.
Рис. 6. Слева — компьютерная обработка фотографий светящихся клеток трех поколений (матери, дочерей и внучек) с указанием старых (красные) и молодых (синие) полюсов. Справа — интенсивность флуоресценции в зависимости от возраста полюса. Изображение из обсуждаемой статьи в Proceedings of the Royal Society B
Тем не менее, если идти путем Чао и коллег, подобную асимметрию придется искать и доказывать для каждого вида одноклеточных. Баптест и соавторы решились высказать более рискованное предположение, которое существенно сокращает путь: они предложили универсальный механизм асимметрии для всех живых существ на Земле, вне зависимости от формы, размера и количества клеток. И связали его с копированием ДНК.
Еще в 1958 году Мэттью Мезельсон и Франклин Сталь обнаружили (см. Эксперимент Мезельсона и Сталя), что перед делением клетки ее геном удваивается полуконсервативным способом, то есть материнская ДНК расплетается на две цепи и к каждой достраивается комплементарная дочерняя цепь (теоретически возможны еще два способа: консервативный — одной клетке достаются две старые цепи, а другой — две новые, и дисперсионный — каждая цепь состоит из старых и новых участков; однако в современных организмах они не встречаются). При этом каждая дочерняя клетка наследует одну «старую» цепь и одну новопостроенную. Согласно современным представлениям, этот процесс происходит в любой делящейся клетке любого живого организма. Поэтому сам по себе механизм деления уже порождает потенциальную асимметрию: из потомков дочерней клетки «старую» цепь получит только один.
Как эта асимметрия может сказаться на жизни дочерних клеток (а точнее, внучек, у которых она проявляется сильнее)? На этот вопрос сегодня нет окончательного ответа, но есть несколько фонарей, под которыми эти проявления можно искать. Первый — это разбавление поломок. Если материнская ДНК несет на себе химические повреждения, то каждая дочерняя клетка наследует только одну из старых цепей — следовательно, повреждений на ее ДНК становится в два раза меньше (здесь не учитываются ошибки, которые могут появиться при репликации), а вред для клетки «разбавляется». Второй — это потеря эпигенетических меток. Материнская ДНК может нести на себе маркеры (метильные группы, например), которые заставляют ее скручиваться в тех или иных местах и запрещают работу определенных генов. Накопление таких меток считается одним из признаков старения клеток, а полуконсервативный механизм может способствовать их разбавлению.
Коль скоро симметричного деления клеток не существует, то асимметрична и каждая клетка, неся в себе «старую» и «новую» цепи ДНК. Следовательно, каждая клетка дает начало одной «старой» дочери, которая наследует «старую» цепь, и одной «омолодившейся», которой достаются новая и еще более новая цепи. Опираясь на эту модель, Баптест и коллеги распространили теорию «одноразовой сомы» на одноклеточные организмы. Они предлагают считать сомой менее «удачливую» из дочерних клеток, а половой линией — ту, которой посчастливилось «омолодиться». Они отмечают, что этот механизм асимметрии, как наиболее универсальный, должен быть и самым древним. Остальные же принципы неравноценного деления, которых известно множество и при которых в материнской клетке остаются белковые агрегаты, поврежденные митохондрии, бракованные молекулы ДНК и прочий «мусор», Баптест и коллеги считают вторичными.
Из этих рассуждений следует, что микроорганизмы можно рассматривать как двухклеточные существа, которые при делении образуют одну клетку-сому и одну «половую» клетку. И только в этой паре имеет смысл говорить о старении (оно достается клетке-соме) или омоложении (которое выпадает на долю «половой» клетки). С этой же позиции можно было бы рассуждать и о том, почему некоторые одноклеточные выбрали для себя явную асимметрию деления (как почкующиеся дрожжи), а другие — скрытую (как кишечная палочка). Впрочем, таких рассуждений уже было немало: например, есть мнение, что чем выше уровень стресса, которому подвергается популяция, тем резче асимметрия, потому что чем сильнее стареет клетка-сома (например, чем больше мусора в ней остается), тем моложе оказывается «половая» клетка и тем больше от этого выигрывает популяция в целом.
Таким образом, если асимметрия универсальна, то у любых одноклеточных существ можно найти признаки асимметрии и старения — как репликативного, так и физиологического. Баптест и коллеги предсказывают, что, если их теория верна, то рано или поздно это получится сделать с любым видом. Репликативную асимметрию измерить легче — достаточно сортировать клетки после каждого деления и подсчитывать, сколько раз они способны произвести потомство. С физиологической асимметрией будет сложнее, однако исследователи полагают, что этого можно достичь, если заблокировать в клетках деление (с этим успешно справляются некоторые яды).
Несправедливость во спасение
Идея о принципиальной асимметрии копирования ДНК тоже возникла не на пустом месте. Об этом заговорили еще в 1975 году, но совсем в другом контексте — как о стратегим защиты от рака (J. Cairns, 1975. Mutation selection and the natural history of cancer). Как и у кишечной палочки, так и у человека каждое копирование ДНК в клетках порождает мутации — ошибки копирования. Но в отличие от кишечной палочки, геном человека устроен куда сложнее — каждый ген (кроме тех, что на половых хромосомах) у нас присутствует в двух копиях. Поэтому каждая новая мутация в дочерней клетке оказывается в гетерозиготном состоянии, и вторая копия гена, как правило, «здорова». А вот среди клеток-внучек найдется такая, которая будет уже гомозиготой по новой мутации. И если эта мутация онкогенная, то в третьем поколении резко возрастает риск опухолевой трансформации.
Гипотеза бессмертной цепи предполагает, что организм животного решает эту проблему, не давая мутантным клеткам размножаться (см. T. Rando, 2007. The Immortal Strand Hypothesis: Segregation and Reconstruction). В организме человека делятся в основном стволовые клетки — представители половой линии в тканях сомы — причем делятся асимметрично: одна дочь остается стволовой и способной к делению, другая уходит в дифференцировку, постепенно превращается в рабочую клетку ткани и теряет способность делиться. Можно представить себе ситуацию, в которой дочь-стволовая клетка наследует преимущественно материнские цепи ДНК без мутаций, а дочь-дифференцированная клетка наследует новые цепи. Да, она может превратиться в раковую клетку, но поскольку ее потенциал к размножению ниже, чем у стволовой, то меньше и риски для ткани в целом (рис. 7).
Рис. 7. Модель сегрегации нитей ДНК в стволовых клетках человека. Клетки, которые остаются стволовыми, наследуют старые цепи, а клеткам, которые уходят в дифференцировку, достаются преимущественно новые. Если эта модель верна, то разделение хромосом в митозе будет неслучайным. Изображение из статьи T. Rando, 2007. The Immortal Strand Hypothesis: Segregation and Reconstruction
Гипотезу бессмертной цепи, казалось бы, несложно проверить. Для этого есть два способа. Первый похож на тот, с помощью которого Мезельсон и Сталь подтвердили полуконсервативный принцип репликации: можно добавить в среду меченые нуклеотиды (например, тимидин с тяжелым атомом водорода) и наблюдать за тем, как они включаются в ДНК новых клеток. Если гипотеза верна, то дочерние клетки будут светиться приблизительно одинаково, а вот в третьем поколении возникнет неравенство. Второй способ более сложный — секвенировать ДНК клеток в ткани, подсчитать количество возникающих мутаций и сравнить его с теоретическими предсказаниями (ведь если все мутации остаются в геноме одной из дочерей, то скорость их накопления в разных клонах будет сильно различаться).
Тем не менее, до сих пор ни окончательно подтвердить, ни полностью опровергнуть гипотезу бессмертной цепи не удалось. В одних работах предсказания не сбываются (C. Tomasetti, I. Bozic, 2015. The (not so) immortal strand hypothesis), в других — сбываются, но на отдельных клеточных культурах, условия жизни которых не воспроизводят реальную ситуацию в ткани.
Итак, что на самом деле сделал Баптест и его коллеги? Опираясь на известные случаи асимметричного деления и полуподтвержденную теорию бессмертной цепи, они предположили, что симметричное деление в природе невозможно. А уже исходя из этого утверждения, они распространили теорию «одноразовой сомы» на все живые организмы.
Баптест полагает, что асимметричное деление — базовый признак, свойственный всем прокариотам и эукариотам. Если предположить, что этот механизм деления — вторично приобретенный, то из этого следует, что ранее существовало истинно симметричное деление и другие механизмы омоложения. Но с учетом того, что все ныне живущие организмы придерживаются полуконсервативного принципа репликации, и мы не знаем наверняка, было ли когда-то по-другому, этот вариант кажется маловероятным.
К этой конструкции, конечно, возникает множество вопросов. Например, насколько логично пытаться применить механизм борьбы с раком у многоклеточных животных к физиологии прокариот? Известно, что у животных существует множество линий противоопухолевой защиты, причем даже у разных классов позвоночных они устроены по-разному. Тогда имеем ли мы право распространить один принцип хотя бы на всех позвоночных, и как быть с беспозвоночными? Строго говоря, и у самих прокариот механизм разделения цепей до сих пор достоверно не обнаружен — хотя известны его косвенные подтверждения (D. K. Aanen, A. J. M. Debets, 2019. Mutation-rate plasticity and the germline of unicellular organisms).
Интересно также, как этот принцип мог бы быть устроен технически, и насколько он может различаться у прокариот и эукариот. В этом смысле с кишечной палочкой все просто: у нее нет ядерной оболочки, да и хромосома только одна. Но как быть с теми же дрожжами, которые, хоть и одноклеточные, обладают полноценным ядром и 16 хромосомами? До сих пор неясно, какой механизм мог бы обеспечивать сегрегацию, чтобы 16 определенных хромосом попали к одному из полюсов.
Тем не менее, теорию Баптеста и коллег можно проверить. Если удастся получить свидетельства об избирательном расхождении хромосом у прокариот и эукариот, то можно будет говорить об универсальности асимметричного деления. А если при этом у прокариот продолжат находить признаки старения, то придется заключить, что этот феномен универсален и забыть о потенциально бессмертных организмах (с которых неплохо бы и нам взять пример). Но старение — палка о двух концах, и если оно универсально, то должны быть универсальны и механизмы омоложения. А значит, мы продолжим обнаруживать и их, одинаковые или разные, но обязательные для любого живого существа.
Источник: elementy.ru