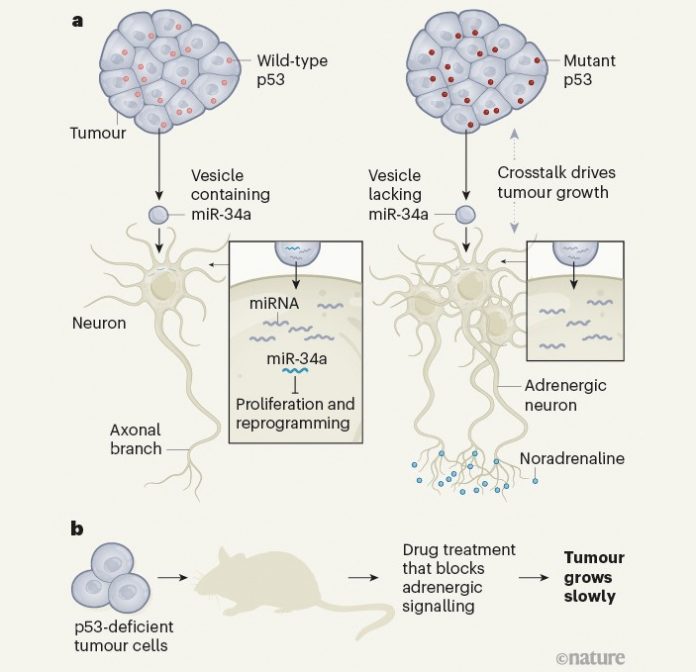
Рис. 1. Графическое представление выводов из обсуждаемой работы — схема того, как опухоли манипулируют нейронами, заставляя их стимулировать развитие рака. Раковые клетки выделяют в микроокружение опухоли везикулы с микроРНК, которые поглощаются в том числе и нейронами. У «обычных» раковых клеток, которые производят нормальный белок р53, в везикулах есть микроРНК miR-34a, блокирующая рост нейронов. Раковые клетки с мутантным р53 секретируют везикулы, в которых нет miR-34a. Из-за этого пронизывающие опухоль нейроны растут, ветвятся и перепрограммируются в адреногенные (продуцирующие норадреналин). Взаимодействие между адреногенными нейронами и раковыми клетками способствует росту опухоли. У мышей, которым трансплантировали раковые клетки и затем лечили блокатором адреногенных сигнальных путей (карведилолом), замедлялся рост опухолей (b). Рисунок из популярного синопсиса к обсуждаемой статье в Nature
Некоторое время назад было установлено, что прорастающие в опухоль нервные волокна способствуют росту опухолей, но почему это происходит, осталось неизвестным. В недавнем исследовании американским ученым удалось показать, что утрата раковыми клетками способности вырабатывать белок р53, который является главным супрессором опухолей, приводит к перепрограммированию сенсорных нейронов из микроокружения опухоли в адреногенные, то есть вырабатывающие адреналины. Именно это и способствовало росту опухолей головы и шеи у мышей. Открытый механизм «диалога» между раковыми клетками и нейронами может стать перспективной мишенью для разработки новых противораковых средств.
Раковые опухоли развиваются в организме не сами по себе. Они постоянно взаимодействуют с окружающими клетками, влияя на них при помощи внеклеточных сигнальных молекул. Совокупность здоровых клеток разных типов, которые находятся в непосредственной близости от опухоли и контактируют с ней, называют микроокружением (см. Tumor microenvironment). Можно сказать, что опухоли эксплуатируют клетки микроокружения в своих интересах: фибробласты помогают им расти, кровеносные сосуды прорастают внутрь опухоли, чтобы доносить туда кислород и питательные вещества, а активность иммунных клеток микроокружения, наоборот, подавляется опухолью, лишая организм части защиты.
В микроокружении есть и нервные клетки, причем нервные волокна прорастают внутрь опухоли уже на самых ранних стадиях ее развития. Уже довольно давно известно, что чем гуще сеть нервных волокон внутри опухоли, тем хуже для пациента прогноз течения и исхода заболевания (см., например, C. Magnon et al., 2013. Autonomic Nerve Development Contributes to Prostate Cancer Progression). Судя по всему, сигналы от нервных волокон играют важную роль в стимулировании роста опухоли, формировании в ней сети кровеносных сосудов, прорастании опухоли в окружающие ткани и образовании метастазов. Но о молекулярных механизмах взаимоотношений нервов и раковой опухоли не было известно практически ничего. Недавно большой коллектив ученых под руководством Морана Амита (Moran Amit) из Онкологического центро имени М. Д. Андерсона, относящегося к Техасскому университету, предпринял попытку в них разобраться.
При раках головы и шеи (при которых поражаются язык, ротовая полость, слюнные железы, гортань или другие органы и ткани головы и шеи), очень часто мутирует ген TP53, являющийся супрессором опухолей (см., например, Главный борец с опухолями ген ТР53 может превращаться в онкоген, «Элементы», 11.11.2015). Его продукт — белок p53 — регулирует клеточный цикл и играет важнейшую роль в предотвращении образования злокачественных опухолей. В случае мутации гена этот белок утрачивает активность. Поскольку в норме р53 участвует и в регуляции правильного формирования нервных волокон, исследователи предположили, что p53 при раках головы и шеи может подавлять взаимодействие нервов и опухоли, а утрата активности p53 усиливает их взаимодействие и способствует прогрессии опухоли.
Анализ клинических данных пациентов с карциномой ротовой полости показал, что густая сеть нервных волокон в раковой опухоли положительно коррелирует с наличием в клетках мутаций гена TP53 и со значительным снижением выживаемости (рис. 2).
Рис. 2. Слева — выживаемость пациентов с карциномой ротовой полости. Хорошо видно, что у пациентов, у которых наблюдалась высокая плотность нервных волокон в опухоли (красный график), выживаемость сильно ниже. Справа — количество нервных волокон на единицу площади среза опухоли у пациентов, в клетках которых были найдены мутации в гене TP53 (красный столбик), и у пациентов без таких мутаций. Здесь хорошо видно, что густота сети нервных волокон положительно коррелирует с наличием мутаций в этом гене. Графики из обсуждаемой статьи в Nature
Поэтому ученые сосредоточились на исследовании взаимодействия между нервами и эпителиальными клетками (с нормальной или нарушенной функцией гена TP53). Эксперименты проводились на генно-модифицированных мышах, у которых можно было избирательно выключить ген TP53 в клетках эпителия (в качестве контроля использовались обычные лабораторные мыши). С помощью сильного канцерогена 4-нитрохинолин-1-оксида у мышей вызывали сначала предраковые изменения тканей ротовой полости, которые затем прогрессировали в раковые опухоли плоскоклеточной карциномы ротовой полости (oral cavity squamous cell carcinoma, OCSCC). И на ранних, и на более поздних стадиях развития рака в опухолях мышей с нарушенной функцией гена TP53 сеть нервных волокон была гораздо гуще, чем опухолях с нормально функционирующим этим геном.
Чтобы детальнее разобраться с нейрогенезом, из мышей извлекали нервные ганглии, которые затем культивировали in vitro совместно с нормальными кератиноцитами ротовой полости или с раковыми клетками, несущими различные мутации гена TP53. Отслеживая прорастание нервных волокон из ганглиев, ученые установили, что клетки с мутациями p53null, p53R273H (приводит к полной утрате функции белка) и p53C238F (нарушает третичную структуру) наиболее активно стимулировали рост нервных волокон. В то же время клетки с мутацией p53G245D (нарушает связь р53 с ДНК) стимулировали рост не так активно.
Чтобы определить, каким путем передается к ганглиям фактор, влияющий на рост нервных волокон, ганглии инкубировали либо с очищенными внеклеточными везикулами (которые секретировались в культуральную среду раковыми клетками с нормальным или с мутантным TP53), либо с культуральной средой без везикул. Оказалось, что именно везикулы транспортируют этот фактор.
Рис. 3. Результаты культивирования нервных ганглиев мышей в среде, в которой либо совсем отсутствовали внеклеточные везикулы (слева), либо присутствовали везикулы, секретируемые раковыми клетками с нормальным или с мутантным геном TP53. Хорошо видно интенсивное прорастание нервных волокон в случае доступа к ганглию везикул из клеток с мутантным TP53. Рисунок из обсуждаемой статьи в Nature
Везикулы — главные переносчики РНК между клетками. В том числе они транспортируют так называемые микроРНК — малые некодирующие молекулы РНК длиной 18–25 нуклеотидов, которые участвуют в регуляции экспрессии генов на уровне транскрипции и трансляции. Сравнение наборов микроРНК из везикул раковых клеток с нормальным и мутантным р53 выявило существенное обогащение первых двумя конкретными видами микроРНК, которые обозначаются miR-34а и miR-141. Блокирование этих микроРНК с помощью специфических антагонистов показало, что рост нервных волокон ганглиев in vitro стимулировался только при блокировании miR-34а. При блокировании синтеза miR-34а в опухолях мышей in vivo наблюдалось увеличение количества нервных волокон, хотя ген TP53 не был нарушен. То же самое наблюдалось в опухолях мышей с нормальным геном TP53 при инъекции везикул из клеток, дефектных по этому гену.
В чем же разница между нервами, прорастающими в опухоли с нормальным и дефектным белком р53? Авторы сравнили наборы мРНК в нейронах. В нейронах ганглиев, обработанных везикулами дефектных по TP53 клеток, по сравнению с везикулами от клеток с нормальным TP53, наблюдалось угнетение транскрипции 1760 генов и усиление транскрипции 2495 генов. Активированные гены были связаны с выживанием и формированием нервов, с их ростом и ветвлением, подавленные — с основными функциями нейронов, в частности — с передачей нервных импульсов в синапсах. Оказалось, что дефектные по TP53 опухоли перепрограммировали нейроны из микроокружения в адреногенные (выделяющие адреналин и родственные ему соединения, маркированные тирозин-гидролазой), и именно они способствовали росту опухолей.
Несколько лет назад было показано, что лекарство карведилол, с помощью которого лечат гипертонию и некоторые сердечные заболевания, значительно снижает вероятность заболеть раком (C. S. Lin et al., 2015. Carvedilol use is associated with reduced cancer risk: A nationwide population-based cohort study). Карведилол блокирует адреногенные пути передачи нервных импульсов. Поэтому авторы решили проверить, может ли его противораковое свойство быть связано со способностью воздействовать на адреногенные нейроны и дефектные по TP53 опухоли мышей. Мышам прививали в язык клетки двух различных дефектных по TP53 линий OCSCC человека. Затем их делили на две группе: в одной мышам давали карведилол, в другой не давали. Сравнение темпов роста опухолей показало, что лечение карведилолом сильно подавляло их развитие.
Подводя итог, можно сказать, что в обсуждаемой работе удалось расшифровать механизмы «диалога» между периферическими нервами и раковыми клетками и показать, что раковые клетки, в которых мутировал ген TP53, вызывают перепрограммирование нервов. Поскольку мутации этого гена являются наиболее частыми онкогенными событиями (они, например, происходят в 60% случаев колоректального рака, в 50–80% случаев рака легких, в 95% случаев рака яичников), то обсуждаемая работа может дать толчок в развитии лекарственных средств, действие которых связано с влиянием на этот ген.
Источник: elementy.ru