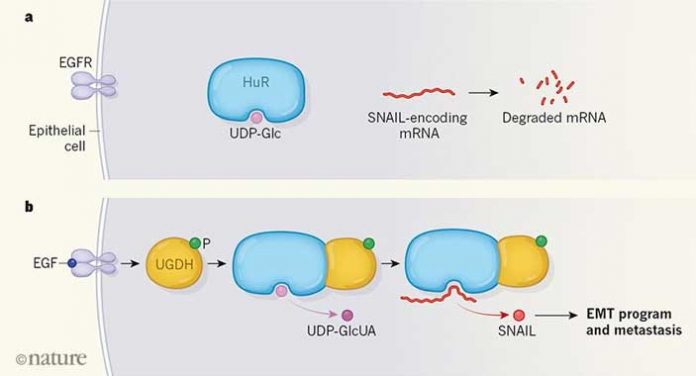
Рис. 1. а. В нормальных эпителиальных клетках рецептор эпидермального фактора роста (EGFR) не активирован, белок HuR связан с уридиндифосфатглюкозой (УДФ-глюкозой, UDP-Glc) — небольшой молекулой, образующейся в процессе обмена веществ. Связанный с УДФ-глюкозой HuR не может связаться с матричной РНК, кодирующей белок SNAIL, и защитить ее, поэтому она быстро деградирует (расщепляется). Благодаря этому белок SNAIL в клетке не накапливается.b. В клетках аденокарциномы легкого эпидермальный фактор роста (EDF), генерируемый опухолью, активирует рецептор. Это запускает фосфорилирование фермента UGDH, который связывается с белком HuR и освобождает его от УДФ-глюкозы, превращая ее в УДФ-глюкуроновую кислоту (UDP-GlcUA). После этого белок HuR может связаться с мРНК и защитить ее; клетка производит белок SNAIL, который запускает эпителиально-мезенхимальный переход. В результате раковая клетка становится подвижной и может образовывать метастазы. Рисунок из синопсиса к обсуждаемой статье
Китайские ученые провели поистине детективное расследование, чтобы разобраться в том, как продукты метаболизма в клетках рака легкого влияют на метастазирование. В результате был расшифрован неизвестный ранее механизм, запускающий переход сцепленных друг с другом эпителиальных клеток в подвижные мезенхимальные, и стало понятно, каким образом скромная молекула уридиндифосфатглюкозы блокирует «спусковой крючок» этого механизма и как эта блокировка преодолевается в раковых клетках. Это исследование не только позволяет совершенно иначе взглянуть на роль метаболитов в развитии рака, но и открывает новые пути в борьбе с образованием метастазов.
В большинстве случаев больные раком погибают не от первичных опухолей, а от метастазов — вторичных опухолей, распространяющихся по различным органам и тканям. Первичную опухоль обычно можно удалить хирургическим путем, но если она успела дать метастазы, то ситуация часто становится безнадежной. Поэтому одна из основных стратегий лечения рака — разработка методов подавления формирования и прогрессии метастазов.
Чтобы отделиться от первичной опухоли, проникнуть в кровеносную или лимфатическую систему и переместиться в новое место для образования метастаза, клетка раковой опухоли должна пройти через ряд модификаций. Так, эпителиальные клетки, формирующие слоистые структуры, должны стать «объемными» — совершить эпителиально-мезенхимальный переход (ЭМП). ЭМП в норме происходит при развитии эмбриона и при заживлении ран, а раковым клеткам он помогает уйти в свободное плавание: мезенхимальные клетки сцеплены между собой гораздо слабее, чем эпителиальные. В экспериментах in vitro культивируемые эпителиальные клетки, прошедшие ЭМП, приобретают способность мигрировать по поверхности лабораторного пластика.
Процесс метастазирования и ЭМП как его этап довольно хорошо изучены на уровне мутирующих генов и белков, кодируемых мутантными генами. В то же время очень мало известно о том, как этот процесс запускается и, в частности, как на него влияют метаболиты — углеводы, аминокислоты, жирные кислоты, нуклеотиды и другие низкомолекулярные соединения, возникающие и превращающиеся в клетке в процессе обмена веществ. Между тем, такое влияние вполне заслуживает изучения, поскольку метаболизм в раковой клетке существенно отличается от обычного: он сдвинут в сторону формирования питательных веществ и источников энергии, в которых нуждается активно растущая опухоль.
Китайские исследователи предприняли практически первую попытку детально изучить влияние метаболитов на ЭМП раковых клеток и, как следствие, на образование метастазов. Авторы сосредоточили внимание на генах, контролирующих метаболизм. С поистине китайской скрупулезностью они по очереди подавляли экспрессию 111 (!) генов в культуре клеток аденокарциномы А549 — рака легких человека, развившегося из эпителия бронхов, — и смотрели, меняется ли подвижность клеток (а значит, происходит ли эпителиально-мезенхимальный переход). Экспрессия каждого гена подавлялась специально синтезированной для этого молекулой — двухцепочечной малой интерферирующей РНК (siRNA) из 20–25 нуклеотидов, способной взаимодействовать с матричной РНК исследуемого гена и выключать ее трансляцию в белок.
Рис. 2. В клетках А549, меченых люциферазой, экспрессия гена UGDH была подавлена специфической короткой шпилечной РНК (UGDH shRNA, внизу) или не подавлена неспецифической короткой РНК (shNT, non-targeted shRNA, вверху). Клетки вводили в вену мышей, через 28 и 30 дней после инокуляции выявляли флюоресцирующие метастазы в легких. Видно, что блокирование гена UGDH заметно подавляет метастазирование. Иллюстрация из обсуждаемой статьи
Таким образом был выявлен ген, выключение которого (через блокаду его мРНК) больше всего подавляло подвижность клеток А549. Он кодирует фермент UGDH — дегидрогеназу уридиндифосфатглюкозы (UDP-glucose 6-dehydrogenase), — превращающий УДФ-глюкозу в УДФ-глюкуроновую кислоту. Про ген UGDH и раньше было известно, что в клетках аденокарциномы легких человека количество его мРНК увеличено по сравнению с нормальной тканью — и чем ее больше, тем выше степень злокачественности опухоли и хуже прогноз течения болезни. Китайские ученые провели эксперименты in vivo на модельных мышах и выяснили, что подавление экспрессии гена UGDH после введения мышам раковых клеток А549 подавляло у них образование метастазов, см. рис. 2.
Дальше нужно было понять, каким образом UGDH (или его отсутствие) влияет на эпителиально-мезенхимальный переход. Снова был применен перебор — на этот раз ученые рассмотрели 14 генов, контролирующих ЭМП, чтобы понять, с каким (или какими) из них взаимодействует UGDH. Выяснилось, что при блокировке гена UGDH резко сокращается выработка белка SNAIL — фактора транскрипции, играющего важную роль в ЭМП и кодируемого геном SNAI1. Причем «слабым звеном» оказалась не транскрипция SNAI1 в матричную РНК и не трансляция мРНК в белок, а стабильность мРНК. В клетках без фермента UGDH мРНК гена SNAI1 быстро разрушалась, и белок почти не вырабатывался.
Ученые стали разбираться, каким образом UGDH влияет на стабильность мРНК SNAI1. И тут выяснилась довольно неожиданная вещь. Было бы естественно предположить, что подавление ЭМП связано с дефицитом продукта работы фермента UGDH — УДФ-глюкуроновой кислоты. Но добавление УДФ-глюкуроновой кислоты на подвижность клеток почти не влияло. Оказалось, что дело в избытке исходного вещества. При блокировке гена UGDH в клетках аденокарциномы начинала накапливаться УДФ-глюкоза, и именно это каким-то образом подавляло ЭМП. Эксперименты на мышах, «зараженных» клетками А549, показали, что у тех из них, которые получали УДФ-глюкозу, образовывалось меньше метастазов.
Оставалось понять механизм влияния УДФ-глюкозы на стабильность мРНК SNAI1. Авторы обратили внимание на белок HuR, про который уже было известно, что он предотвращает деградацию мРНК ряда генов, включая SNAI1, связываясь с их 3′-хвостами (см. 3′-end). Выяснилось, что УДФ-глюкоза может образовывать с HuR комплекс и тем самым «выключать» его, не давая присоединять мРНК и стабилизировать ее, cм. рис. 3.
Рис. 3. На обоих рисунках показан комплекс белка HuR (голубой) с 3′-концом мРНК (зеленый). Слева на него наложена УДФ-глюкоза (UDP-Glc), справа — УДФ-глюкуроновая кислота (UDP-GlcUA). Обе малых молекулы показаны структурными формулами (шарики обозначают атомы, линии — связи между ними), а также окружающими их ван-дер-ваальсовыми поверхностями (см. Van der Waals surface; оранжевый и розовый цвета). Видно, что УДФ-глюкоза гораздо лучше, чем УДФ-глюкуроновая кислота, может конкурировать с мРНК за связь с HuR.
Как и на других этапах описываемого исследования, чтобы проверить, что важен именно этот механизм, был проведен элегантный эксперимент. Был сконструирован мутантный ген, кодирующий HuR, который, вследствие замены всего одной аминокислоты на другую, терял способность соединяться с УДФ-глюкозой. Эта мутация не мешала стабилизировать мРНК. Поэтому даже при избытке УДФ-глюкозы раковые клетки, продуцирующие мутантный HuR, сохраняли и подвижность in vitro, и способность формировать метастазы у мышей.
И наконец, последний штрих — как весь этот каскад запускается. Известно, что в клетках рака легких человека, как правило, активирован рецептор эпидермального фактора роста (ЭФР). Авторы показали, что при активации этого рецептора (т. е. при присоединении к нему ЭФР) один из тирозиновых остатков фермента UGDH фосфорилируется. Фосфорилированный UGDH (pUGDH) получает способность образовывать комплекс с HuR, см. рис. 1b. Судя по всему, именно при присоединении к белку HuR фермент pUGDH освобождает его от УДФ-глюкозы (которая превращается в УДФ-глюкуроновую кислоту) и тем самым позволяет ему связаться с мРНК SNAI1 и защитить ее. Белок SNAIL начинает активно вырабатываться, что, в свою очередь, приводит к запуску эпителиально-мезенхимального перехода, а затем и к метастазированию.
И опять эта гипотеза была проверена тонким экспериментом, при котором один из начальных этапов механизма выключался точечной мутацией. На этот раз мутация вносилась в ген UGDH: на месте того самого тирозина (в 473-й позиции), который фосфорилируется при активации рецептора эпидермального фактора роста, кодировалась другая аминокислота, фенилаланин. И снова это сработало. После активации рецептора ЭФР фосфорилирования UGDH не происходило, фермент не соединялся с HuR и не освобождал его от УФД-глюкозы. В результате модифицированные клетки A549, продуцирующие такой мутантный UGDH, после их введения модельным мышам давали значительно меньше метастазов, и мыши жили намного дольше.
Авторам удалось подтвердить полученные ими результаты клиническими данными. Повышенный уровень фосфорилированного UGDH у пациентов с аденокарциномой легких оказался связанным с негативным прогнозом течения болезни. Из 105 пациентов, которых лечили после операции одинаковыми химиотерапевтическими препаратами и радиотерапией, 32 с высоким уровнем рUGDH прожили в среднем 43 месяца, а 73 с низким уровнем рUGDH — 60 месяцев (рис. 4). Отмечается также, что в метастазах наблюдается больше рUGDH, чем в первичных опухолях, от которых произошли соответствующие метастазы.
Рис. 4. Выживаемость (в месяцах) больных аденокарциномой легких с низким и высоким содержанием фосфорилированного UGDH в опухолях при одинаковом лечении. График из обсуждаемой статьи
Полученные результаты принципиально отличаются от уже достаточно хорошо исследованных случаев, когда метаболиты, накапливающиеся в результате мутаций генов, ассоциированных с раком, способствуют развитию рака (см., например, A. Intlekofer, L. Finley. Metabolic signatures of cancer cells and stem cells. Nature Metabolism. V. 1 (2019). Р. 177-188). УДФ-глюкоза, наоборот, оказалась способной подавлять реализацию первых стадий формирования метастазов. Таким образом, авторам удалось открыть до сих пор не известный механизм, посредством которого низкомолекулярные метаболиты могут подавлять ЭМП раковых клеток и в результате подавлять метастазирование.
Обсуждаемая работа открывает принципиально новое направление исследований влияния метаболитов на возникновение и прогрессию рака. Анализ метаболитов может быть использован при диагностике рака. УДФ-глюкоза, а возможно, и другие метаболиты могут лечь в основу новых методик лечения. И хотя перспективы их применения в клинике пока не ясны, эта работа лишний раз убедительно показывает, что китайские ученые всё более уверенно выходят на передовые позиции в мировой науке.
Источник: elementy.ru